Molekulare Energietrichter
31.05.2007
Wie wandeln Bakterien, Algen und Pflanzen die durch das Sonnenlicht verfügbare Energie in für sie nutzbare Energieformen um? Auf der Suche nach einer Antwort stößt man auf molekulare Antennen, in denen die Natur auf vielfältige Weise Energietrichter zur effizienten Initiierung der Photosynthese realisiert hat.
|
|
Sonnenenergie ist die Quelle des Lebens. Vor allem die Energie des Lichtes im sichtbaren Spektralbereich wird von einer Reihe von Organismen für die Photosynthese genutzt. Dabei wird von Pflanzen und Algen Kohlendioxid gebunden und Sauerstoff freigesetzt. Einige Bakterienarten, wie Schwefelbakterien, nutzen die Photosynthese zum Überleben in ökologischen Nischen, ohne dabei allerdings Sauerstoff zu produzieren. Im Verlauf der Evolution haben diese Organismen hochspezialisierte Photosynthese-Apparate entwickelt, die ihnen eine effiziente Umwandlung der Lichtenergie in nutzbare chemische Energie erlauben. Doch wie sehen die allgemeinen Bauprinzipien in diesen Photosynthese- Apparaten aus? Bahnbrechende Untersuchungen hierzu wurden schon 1932 von den Forschern Emerson und Arnold durchgeführt: Durch Messung der Sauerstoffproduktion nach Blitzlichtanregung entdeckten sie, dass ungefähr 2.500 Chlorophyllmoleküle an der Erzeugung eines Sauerstoffmoleküls beteiligt sind.
|
|
Antennensystem
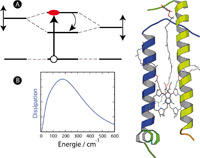
Erst später wurde klar, dass es sich um lichtsammelnde Antennensysteme handelt, die ein sogenanntes Reaktionszentrum umgeben. Aufgabe der Antennen: Die „eingefangene“ Lichtenergie zum Reaktionszentrum transportieren, damit dort die chemischen Reaktionen der Photosynthese angetrieben werden können. Dabei wird fast jedes aufgenommene Licht-Quant (Photon) für die photo-chemische Konvertierung genutzt. Verschiedene experimentelle und theoretische Methoden der Biologie, Chemie und Physik wurden in den letzten Jahren gezielt eingesetzt, um den molekularen Grundlagen dieser effizienten Ressourcen-Nutzung auf die Spur zu kommen. Eine immer wiederkehrende Frage ist die nach dem Verhältnis von molekularer Struktur und Funktion. Der Begriff Struktur umfasst dabei die Geometrie der Atome in einem Komplex aus Proteinen und Pigment-Molekülen. Dieses statische Bild, das sich in Röntgenbeugungsexperimente zeigt, lässt nur auf einen Teil der Prozesse Rückschlüsse zu. Dem gegenüber steht der dynamische Aspekt: Er ist einerseits Konsequenz der thermischen Atom-Bewegungen, andererseits spielt er eine entscheidende Rolle, wenn die Elektronen durch das Licht angeregt werden. Was aber geschieht zunächst mit der Energie des Photons in diesem Komplex? Wie bewegt sich die Energie innerhalb der Antenne hin zum Reaktionszentrum? Wie wird sichergestellt, dass Energie möglichst effizient in eine Richtung fließt? Kurzum, wie werden die Antennen-Komplexe zu einem molekularen Energietrichter mit dem Reaktionszentrum als energetische Senke?
Energietransfer
Lichteinstrahlung mit entsprechender Wellenlänge löst in einem Pigment-Molekül wie dem Chlorophyll (Chl) eine elektronische Anregung aus. Ist kein weiteres Pigmentmolekül in der Nähe, zerfällt dieser Anregungszustand nach einiger Zeit wieder. Befindet sich ein anderes Pigmentmolekül aber in nur wenigen Nanometern Entfernung, kann es zu einer Übertragung der Anregungsenergie kommen. Die grundlegenden Vorstellungen zur Beschreibung des Energietransfers gehen auf Arbeiten des Physikochemikers Theodor Förster aus den 1940er Jahren zurück. Das Phänomen der Energiewanderung ist allerdings nicht auf photosynthetische Antennen begrenzt.
|
|
Schon in den 1920er Jahren hatte der Nobelpreisträger Jean Perrin entsprechende Prozesse untersucht, die in Lösungen von Farbstoffmolekülen auftreten. Ein Modell dazu war von seinem Sohn Francis Perrin entwickelt worden. Försters Verdienst war es nun, diese Vorstellung um wichtige Aspekte wie den Einfluss der Atomkernbewegung zu erweitern, und in eine theoretische Form zu bringen, die unmittelbar in Beziehung zu experimentellen Messgrößen steht. Die sogenannte Förster-Rate für den Anregungsenergietransfer zwischen einem Donator und einem Akzeptormolekül ergibt sich aus dem Fluoreszenzspektrum des Donators und dem Absorptionsspektrum des Akzeptors. Diese Spektren enthalten die Information über die Bewegung der Atome des Pigments und seiner Proteinumgebung. Eine wichtige Erweiterung wird jedoch erforderlich, wenn der Abstand zwischen zwei benachbarten Pigmenten klein wird – und ihre Wechselwirkung damit sehr groß. In diesem Fall können sich nach der Anregung Zustände herausbilden, die über mehrere Moleküle ausgedehnt sind. Durch die Wechselwirkung und die relativen Orientierungen der Pigmente werden die ausgedehnten Zustände normalerweise mit unterschiedlichen Wahrscheinlichkeiten durch das Licht angeregt; im Extremfall wird nur ein einziger ausgedehnter Zustand angeregt.In photosynthetischen Antennensystemen verteilt sich die Anregung über mehrere, teilweise ausgedehnte Zustände. Nach optischer Anregung kommt es dabei zu einer Umverteilung der Anregungsenergie: Es stellt sich ein thermisches Gleichgewicht der angeregten Zustände ein, zu dem der Zustand mit der geringsten Energie am stärksten beiträgt. Die bei diesem als „Energiedissipation“ bezeichneten Prozess frei werdende Energie wird in Kernbewegungen umgewandelt.
|
|
Energiedissipation ermöglicht letztlich den gerichteten Energietransfer im Antennenkomplex und stellt somit seine Funktion als Energietrichter sicher. Ein detaillierter Einblick in den zeitlichen Ablauf dieser Prozesse wurde erst durch Fortschritte auf dem Gebiet der Ultrakurzzeit-Spektroskopie möglich. Während die Lichtblitze von Emerson und Arnold eine Dauer von 10 Mikrosekunden (10-6 s) hatten, sind heutzutage Laserpuls-Dauern von 100 Femtosekunden (10-15 s) üblich. Anhand der Lichtsammel-Komplexe verschiedener Bakterien und Pflanzen kann man erkennen, welche Strategien die Natur entwickelt hat, um diese Grundprinzipien in molekularen Energietrichtern photosynthetischer Systeme umzusetzen.
Photosynthese-Apparate
Purpurbakterienarten wie Rhodopseudomonas virdis oder acidophila gehören sicher zu den am besten charakterisierten Spezies. Ihr Lebensraum befindet sich am Boden von Gewässern und unterhalb von Organismen wie Pflanzen, Algen und Cyanobakterien, die Sauerstoff bilden. Die Photosynthese dieser sauerstoffbildenden Organismen wird durch Chlorophyll angetrieben, das im blauen und roten Bereich des sichtbaren Spektrums Licht absorbiert – daher auch die grüne Farbe. Die unterhalb dieser Organismen lebenden Purpurbakterien nutzen das Licht im nahen Infrarot- und im grünen Spektralbereich, das von den sauerstoffbildenden Organismen durchgelassen wird. Dabei kommt insbesondere Bakteriochlorophyll-a (BChl-a) als photoaktives Pigment zum Einsatz.
 |
 |
|
Im linken Teil der Abbildung ist der Energiefluss in der photosynthetischen Einheit von Purpurbakterien schematisch veranschaulicht. Das Reaktionszentrum (RC) wird vom Lichtsammelkomplex LH1 umgeben, der wiederum die Anregungsenergie von einer Reihe von Antennen (LH2) empfängt. Im rechten Teil der Abbildung ist ein LH2-Komplex im Detail gezeigt (Quelle: T. Pullerits, privat). Die B850-Pigmente (grün) sind eng gepackt und wie das Schaufelrad einer Wassermühle angeordnet, währenddessen die B800-Pigmente (blau) in relativ großen Abständen senkrecht dazu liegen. |
|
Der Lichtsammel-Apparat der Purpurbakterien ist ein Beispiel für die Steuerung des gerichteten Energietransfers durch die spezielle räumliche Anordnung der Pigmente. Die photosynthetische Einheit besteht aus zwei Arten von Antennenkomplexen, der äußeren Antenne (LH2) und der inneren (LH1), die das Reaktionszentrum unmittelbar umgibt. Beim LH2-Komplex sind BChl-a-Moleküle in zwei Ringen angeordnet. Ein Ring wird von neun sogenannten B800-Molekülen gebildet, deren Absorptionsmaximum bei 800 Nanometern liegt, und ein zweiter Ring von 18 B850-Molekülen, der die stärkste Absorption bei 850 Nanometern zeigt. Warum aber wird Licht von chemisch identischen Moleküle mit unterschiedlicher Wellenlänge absorbiert? Die Absorption der B800-Pigmente unterscheidet sich nur geringfügig von derjenigen in einem Lösungsmittel, für die B850-Pigmente bildet sich jedoch wegen der engen „Packung“ ein Anregungszustand, der sich über mehrere BChl-a-Moleküle erstreckt.
|
|
Die Folge: Die Energie ist in diesem Zustand abgesenkt, und die Absorption wird bei größeren Wellenlängen möglich. Bei Ultrakurzzeit-Experimenten konnte man feststellen, dass die ausgedehnten Anregungszustände im LH2 nicht statisch sind. Aufgrund der Kernbewegung kommt es zu einer Dynamik des angeregten Zustandes im B850-Ring auf einer Zeitskala von Subpikosekunden. Die Anregungsenergie kann weiterhin auf B850-Ringe von benachbarten LH2-Komplexen übergehen und erreicht schließlich den aus 32 stark gekoppelten BChl-a-Molekülen aufgebauten LH1-Ring, der ein Absorptionsmaximum bei 875 Nanometern besitzt. Durch die Erhöhung der Anzahl stark gekoppelter Moleküle erfolgt in diesem Fall eine Absenkung der Anregungsenergie gegenüber dem B850-Ring des LH2. Damit gelingt es, die Anregungsenergie zunächst im LH1-Ring zu konzentrieren, bevor sie schließlich in das Reaktionszentrum im Inneren des LH1 übergeht. Dabei fungiert ein sehr stark gekoppeltes Paar aus zwei BChl-a-Molekülen, das sogenannte „special pair“, als Anregungsenergie-Akzeptor und als Initiator der photochemischen Prozesse.
Proteinumgebung
Eine weitere Möglichkeit, einen Energietrichter zu erzeugen, ist der Einsatz chemisch unterschiedlicher Pigmente und die gezielte Steuerung der Anregungsenergien der Pigmente durch ihre lokalen Proteinumgebungen. Diese Strategien werden im Antennensystem der grünen Schwefelbakterien und im Lichtsammel-Apparat der Pflanzen realisiert. Schwefelbakterien haben – wie die Purpurbakterien – eine ökologische Nische besetzt. Sie leben in salzhaltigen Gewässern in großer Tiefe und benutzen Schwefelwasserstoff als Elektronenquelle für die Photosynthese. Sie haben sich in bis zu 80 Metern Tiefe an sehr geringe Lichtintensitäten angepasst, was ihnen durch die Ausbildung eines äußeren Antennensystems mit einer großen Zahl an selbstorganisierten BChl-c-Molekülen gelang. In diesen sogenannten Chlorosomen („grüne Säcke“) sind bis zu 10.000 Moleküle gebunden, die ihre Anregungsenergie über das sogenannte FMO-Protein zum photosynthetischen Reaktionszentrum leiten. Das FMO-Protein ist ein „Trimer“, dessen monomere Untereinheit sieben BChl-a-Moleküle bindet (siehe Abbildung auf Seite 63). Da Bchl-a aufgrund der unterschiedlichen chemischen Struktur energetisch unterhalb von BChl-c absorbiert, ergibt sich ein Energiegefälle von den Chlorosomen zum FMO-Komplex. Innerhalb des FMO-Komplexes, dessen Kristallstruktur als erste eines Pigment-Proteinkomplexes vor mehr als 30 Jahren durch die Biochemiker Fenna, Matthews und Olson aufgedeckt wurde, baut sich ein Energietrichter dadurch auf, dass die Anregungsenergie der Pigmente durch ihre lokalen Proteinumgebungen gezielt verändert werden. Detaillierte Berechnungen ergaben, dass die energetische Senke im FMO-Komplex bei BChl 3 auftritt, was Rückschlüsse auf die Orientierungen des FMO-Komplexes in Bezug auf das Reaktionszentrum erlaubt.
|
|
Es stellt sich somit die Frage nach den molekularen Mechanismen der Wechselwirkung von Pigment und Protein, die zur energetischen Senke bei BChl 3 führen. Für die Verschiebung optischer Übergangsenergien von Pigmenten in die Proteinumgebung gab es bis vor kurzem lediglich qualitative Vorstellungen. Diese beruhten meist auf Berechnungen der Pigmente und kleinen Teilen ihrer Proteinumgebung sowie auf Studien an Mutanten, in denen die Proteinumgebung einzelner Pigment verändert wurde. Wesentliche Aspekte lassen sich anhand des Differenzpotenzials des angeregten Grundzustandes der Pigmente verstehen. Das Differenzpotenzial zeigt, wie elektrische Felder in der Umgebung der Pigmente deren optische Übergangsenergien verschieben. Es ist kürzlich in der Arbeitsgruppe von Thomas Renger erstmalig gelungen, die optischen Übergangsenergien der Pigmente des FMO-Komplexes direkt zu berechnen und damit optische Spektren zu erklären. Entscheidend für den Fortschritt war eine detaillierte Berücksichtigung der elektrischen Felder des gesamten Proteins und der Grund- und angeregten Zustände der Pigmente.
Pflanzen
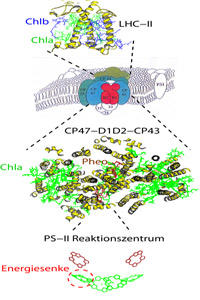
Pflanzen besitzen zwei Photosysteme. Photosystem II hat die Aufgabe, Wasser zu spalten, wobei der molekulare Sauerstoff, Grundlage des Lebens aller aeroben Organismen, als Nebenprodukt entsteht. Etwa die Hälfte aller auf der Erde vorkommenden Chlorophylle sind im peripheren Lichtsammelkomplex LHC-II des Photosystems II gebunden. Der LHC-II besitzt eine Trimer-Struktur, wobei in der monomeren Untereinheit neben 8 Chl-a-Molekülen noch 6 Chl-b- Moleküle enthalten sind.
Im Gegensatz dazu wird im Reaktionszentrum und den angrenzenden Lichtsammelkomplexen lediglich Chl-a gefunden. Da Chl-b bei höheren Energien Licht absorbiert, ist hier wiederum ein molekularer Energietrichter in Richtung Reaktionszentrum realisiert. Obwohl die Pigmente im Reaktionszentrum des Photosystems II sehr ähnlich zu denen des Reaktionszentrums der Purpurbakterien angeordnet sind, gibt es einen entscheidenden Unterschied: Die Kopplung im zentralen Chl-a-Dimer, „special pair“ genannt, ist im Photosystem II wesentlich geringer.Als Konsequenz wird die Energiesenke im Reaktionszentrum des pflanzlichen Photosystems II nicht wie bei den Purpurbakterien durch das „special pair“ gebildet, sondern durch ein benachbartes Chl-a-Molekül. Es ist also wahrscheinlich, dass die Photochemie an diesem Chlorophyllmolekül startet. Die funktionellen Vorteile eines solchen Anfangszustandes sind noch unbekannt.
|
|
Künstliche Antennen
Blickt man auf die Untersuchungen zu den ersten Schritten der Photosynthese zurück, wird deutlich, dass sich die Natur einer Reihe von grundlegenden Konstruktionsprinzipien bedient, um eine effiziente Nutzung der zur Verfügung stehenden Energie des Sonnenlichtes zu gewährleisten. Dazu gehört – neben einem Arsenal von Pigmentmolekülen und deren räumlicher Anordnung – vor allem die Verschiebung der Energien der Pigmente und die Dissipation der Überschussenergie durch Proteinumgebung. Doch können die Konzepte übertragen werden? Hat die Natur eine Bauanleitung für künstliche Lichtsammelkomplexe bereitgestellt? Erste Erfolge bei der Synthetisierung künstlicher Antennen sind vielversprechend. Wie es um die Photostabilität derartiger Komplexe bestellt ist, weiß man aber noch nicht: Die Natur hat an dieser Stelle vielfältige Schutz- und Reparaturmechanismen entwickelt, die jedoch noch weitestgehend unverstanden sind. Nur eines kann man mit Sicherheit sagen, nämlich dass die Konzepte der Photosynthese uns wichtige Impulse bei der Lösung des Energieproblems liefern werden.